Cyanamid
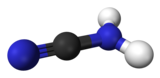
Cyanamid är en amid av cyansyra med formeln CN2H2.[1]
| Cyanamid | |
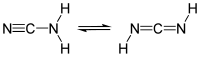  | |
| Systematiskt namn | Cyanamid |
|---|---|
| Övriga namn | Aminonitril |
| Kemisk formel | CN2H2 |
| Molmassa | 42,04 g/mol |
| Utseende | Färglösa kristaller |
| CAS-nummer | 420-04-2 |
| SMILES | N#CN |
| Egenskaper | |
| Densitet | 1,28 g/cm³ |
| Löslighet (vatten) | 850 g/l (25 °C) |
| Smältpunkt | 44 °C |
| Kokpunkt | 260 °C (sönderfaller) |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| LD50 | 125 mg/kg (råtta) 150 mg/kg (kanin) 388 mg/kg (mus) |
| SI-enheter & STP används om ej annat angivits | |
Egenskaper
redigeraCyanamid har en struktur som liknar cyanväte, men är inte lika giftig. Den är en syra med pKa = 1,1[2] och kan bilda salter med alkalimetaller av vilka kalciumcyanamid (CaCN2) är den vanligaste.
Cyanamid är ett dehydrogeneringsmedel och kan driva kondensationsreaktioner.
Framställning
redigeraCyanamid framställs vanligen genom hydrolys av kalciumcyanamid.
Cyanamid kan också framställas genom att reagera cyanklorid (CNCl) med ammoniak (NH3).
Användning
redigeraCyanamid används främst för tillverkning av urea (CO(NH2)2) och tiourea (CS(NH2)2) genom reaktion med ett protiskt lösningsmedel som vatten eller svavelväte.
Se även
redigeraKällor
redigera- ^ Safety data for cyanamide Arkiverad 11 juni 2010 hämtat från the Wayback Machine. Oxford University
- ^ pKa values index[död länk]
- Wikimedia Commons har media som rör Cyanamid.
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Cyanamide, tidigare version.
- Den här artikeln är helt eller delvis baserad på material från tyskspråkiga Wikipedia, Cyanamid, tidigare version.
